Aprende en Casa III SEP: 8 de febrero TAREAS y ACTIVIDADES de 3° de secundaria
A continuación dejamos los temas vistos el 8 de febrero de clases virtuales mediante el programa Aprende en Casa III, para los alumnos de 3° de secundaria.

Para todos aquellos padres y madres de familia cuyos hijos se encuentran cursando el nivel Secundaria de educación básica y toman las clases en línea por medio del programa de la SEP Aprende en Casa III, compartimos los temas y actividades que se abordaron este Lunes 8 de febrero, así como las dudas que se plantearon.
La información que obtendrás a continuación forma parte del material educativo que se vio en el apartado Actividades, del nivel Secundaria, publicado en la página oficial del programa Aprende en casa III:
https://aprendeencasa.sep.gob.mx/#

Compra en Amazon
La ortografía de mis experimentos
Aprendizaje esperado: Describe los procesos observados y los presenta de manera organizada.
Énfasis: Revisar ortografía convencional.
¿Qué vamos a aprender?
En esta sesión abordarás la escritura del idioma español.
Te acercarás al conocimiento de la lengua materna para estar en posibilidades de emplearla correctamente. También te acercarás a la escritura de un tipo de textos sumamente útiles para el conocimiento y difusión de la ciencia: los informes sobre experimentos.
Es necesario que tengas a la mano tu cuaderno, un bolígrafo y tu libro de texto.
A medida que transcurra la sesión, toma nota de las ideas, palabras clave, hagan algún esquema, escribe lo que sea útil para recordar y afianzar el aprendizaje esperado; anota también las dudas que vayan surgiendo para que puedas aclararlas con ayuda de tu maestra o maestro o consultando tu libro de texto.
¿Qué hacemos?
Observa el siguiente video:
- VIDEO
¿En algún momento te has sentido como Valeria? ¿Consideras que lo relacionado con la ciencia es complejo y distante?
Así como ella, basta un poco de reflexión para comprender que la ciencia es el camino para saber más sobre el entorno y todo aquello que habita en el mundo y el universo.
La ciencia es la mayor empresa colectiva de la humanidad. Sus beneficios son incontables: cuida nuestra salud, proporciona medicamentos que curan enfermedades, alivian dolores y sufrimiento, suministra energía con todo, hace la vida más agradable; es también una de las vías para generar conocimiento.
En la educación secundaria se promueve el acercamiento a la ciencia mediante las asignaturas de Biología, Física y Química, con el fin de que tú, desarrolles las habilidades fundamentales del pensamiento científico, tales como observar, inferir, analizar, clasificar y puedas plantearte preguntas, hacer suposiciones, procesos, obtener conclusiones.
Así, la observación, experimentación, formulación de hipótesis, razonamiento y demostración son, además de pasos del método científico, prácticas que generan un pensamiento creativo, así como la comprensión de fenómenos de naturaleza cada vez más compleja.
En los laboratorios es posible realizar experimentos científicos controlando las condiciones ambientales que existen, pues ahí se encuentran los medios y materiales necesarios para realizarlos.
Hacer experimentos moviliza el razonamiento, despierta la curiosidad intelectual; además, promueve la comunicación clara y precisa de todo lo que se realiza mediante los informes.
Dichos informes son textos en los que se registran claramente propósitos, hipótesis, material necesario, desarrollo, resultado y conclusiones del experimento. Son, asimismo, una constancia de que un investigador realizó el experimento y es útil para que otros investigadores logren reafirmar y aportar conocimientos nuevos.
En un acercamiento con la realidad que ocurre en los grandes laboratorios del mundo, en la secundaria se realizan experimentos y se elaboran informes.
Seguramente has realizado una gran cantidad de ellos. ¿Recuerdas las partes que los conforman?
Con más o menos detalles, pero generalmente tienen:
-Título.
-Autor o autores, en caso de haber realizado la práctica en equipo.
-Introducción, donde se anotan objetivo e hipótesis.
-Desarrollo, donde se enlistan los materiales que se emplearon y se describe con detalle todo el proceso realizado.
-Resultados, donde suelen, además del texto explicativo, elaborarse gráficas o tablas.
-Conclusiones.
-Bibliografía.
Naturalmente, la información plasmada en dicho texto debe de ser clara, correctamente escrita, pues de lo contrario podría generar confusión, de ahí que cuidar la ortografía sea esencial.
Como ejemplo, se tomaron cuatro informes elaborados por alumnos de tercer grado de secundaria y se observó específicamente, la ortografía. Se notan algunas debilidades que es preciso señalar para que no las cometas. Leerás solo uno para que sea más claro.
CAMBIOS QUÍMICOS
Introducción
Descubrir cambios químicos a través de cambios de color.
Hipótesis
Distintas soluciones se mezclan y provocan cambios de color en la col.
Material
Media col morada un cuchillo una cacerola, agua un trozo de tela limpia 7 vasos transparentes jugo de limón vinagre amoniaco bicarbonato ácido acetilsalicílico, una tableta de antiácido una bebida con gas y etiquetas blancas
Procedimiento
1-Se picó finamente media col morada la parte de arriba que es la más coloreada y se hirvió 5 minutos en un litro de agua, se puso a enfriar y se colocó a través de la tela luego se vertió el líquido en seis vasos de vidrio transparente llenándolos hasta la mitad luego se etiquetaron los vasos y se les puso un número.
2-Se molieron dos tabletas de ácido acetilsalicílico y se revolvieron con agua caliente, se pusieron a enfriar para luego colarse a través de la tela se hizo igual con una tableta de antiácido y con una cucharadita de amoniaco a un cuarto de taza de agua, se puso una etiqueta a cada vaso con su nombre
3-Se vertió en los vasos que contienen liquido rojo el volumen suficiente de solución de antiácido bicarbonato o amoniaco para que cambiara de color
4-Se añadió a los vasos que contienen liquido azul el volumen suficiente de jugo de limón vinagre o solución de ácido acetilsalicílico para que cambiaran de color
¿Qué advierte este fragmento?
Seguramente te das cuenta que no se entiende bien porque tiene faltas de ortografía.
¿En qué aspecto ortográfico hay más debilidades?
En la puntuación y en la acentuación.
Entre los signos más usuales se encuentran la coma y el punto; también, aunque se emplean con menor frecuencia, están el punto y coma y el paréntesis.
Como bien sabes, la coma indica una pausa breve; es el signo más conocido y usual de todos.
El punto una pausa un poco más prolongada; también es muy usual y se emplea para separar ideas.
El punto y coma también indica pausa, un poco más prolongada que la de la coma.
El paréntesis encierra una aclaración.
Al texto de tu compañero le faltan signos, coloca los signos de puntuación faltantes.
¿Has tenido la experiencia de leer un texto donde no hay un solo signo de puntuación? No se entiende, queda mucho a la interpretación de quien lee, crea confusión.
Cuando escribas, piensa en el lector y coloca las pausas qué harías como si estuvieras hablando.
En nuestro idioma, para indicar una pregunta, se emplean los signos interrogativos ¿? que son dos, uno para abrir y otro para cerrar la pregunta. Lo mismo sucede con los signos de exclamación: ¡! Uno (¡) se emplea para abrir, y otro (!) para cerrar la expresión de sorpresa. Hay quienes sólo emplean un signo, el de cerrar, lo cual es incorrecto.
Usa siempre ambos signos; no olvides al que abre la pregunta o la exclamación.
Regresa al informe. Céntrate en la acentuación.
Observa que hay varias palabras que deben llevar acento y no lo tienen. Coloca los acentos
Nota cómo hay más claridad en el texto.
Pero ¿cómo saber si una palabra lleva o no, acento escrito?
Recuerda los principios básicos de acentuación.
Las palabras de más de una sílaba tienen una que se pronuncia con mayor intensidad: se llama tónica. Observa: experimento-oxígeno–conclusiones.
No todas las palabras llevan tilde en la sílaba tónica; en la mayoría sólo se pronuncia:
Observa:
matraz-ciencia-material-conclusiones- volumen–examen
Son palabras sin tilde.
oxígeno–ácido–clorhídrico-evaporación
Son palabras con tilde.
Para la acentuación se ha dividido a las palabras en agudas, graves, esdrújulas y sobresdrújulas, a fin de facilitar su acentuación escrita; recuerda:
a) Las palabras agudas tienen la sílaba tónica al final:
bisturí–reacción-compás
matraz-reloj-control-observar
Nota que sólo llevan tilde si terminan en n, s o vocal.
b) Las palabras graves (también llamadas llanas) tienen la sílaba tónica en penúltimo lugar: volumen-examen-masa-útil-lápiz–ámbar.
Como puedes notar, sólo llevan tilde las palabras que finalizan en cualquier letra que no sea n, s o vocal.
c) Las palabras esdrújulas son largas, llevan la sílaba tónica en antepenúltimo lugar y todas se acentúan: química–ácido–átomo–hidrógeno.
En el informe de tu compañero hay varias palabras esdrújulas, por eso a todas coloca el acento: propósito-hipótesis-químicos-número-ácido–acetilsalicílico.
a) Las palabras sobresdrújulas son más largas que las esdrújulas, derivan de un verbo; todas llevan tilde: imagínatelo, incorpóraselos, sustitúyasela, cópiamelo.
Hay ciertas palabras con acentuación variable, dependiendo de cómo se pronuncien. Por ejemplo, áloe o aloe, pero los principios que se mencionan son generales y te ayudarán a identificar cuáles palabras llevan tilde y cuáles no.
Así también hay infinidad de palabras usuales que no deben llevar tilde, como: examen–volumen–realizaron– mezclaron –hicieron–repitieron y es común encontrarlas acentuadas en informes y todo tipo de textos. Cuidado con ello.
Tienes aquí otro fragmento de un informe de experimento, realizado con el propósito de medir los cambios de temperatura durante la elaboración de jabón casero.
Se tomaron las partes correspondientes a los resultados, conclusiones y referencias.
Resultados
*Se observó que la temperatura inicial del agua era de 28° C y al revolverla con la sosa (NaOH) y la sal alcanzó los 34°C. Al calentar la sosa con el agua (H2O) alcanzó los 70°C lo que se conoce como reacción exotérmica; es decir, liberación de energía en forma de calor.
*Al revolver con el aceite se llegó a un punto de ebullición de 90°C. se retiró la mezcla del fuego y bajó a 40°C. después, cuando estuvo a 20°C se vació en los moldes.
*la reacción exotérmica se produce cuando se mezcla el agua con la sosa, como resultado obtuvimos barras de jabón sólido.
conclusiones
*observamos que la hipótesis se cumple, pues cuando las grasas (como el aceite de cocina) se mezclan con sustancias no ácidas o álcalis (como la sosa mezclada con agua) y se añade calor, se produce una mezcla que se hará sólida al enfriarse. Si las sustancias están frías no pueden mezclarse.
bibliografía
Quesada mora, Silvia. Manual de experimentos para laboratorio de bioquímica. san José, Costa rica. Universidad estatal, 2007, p.62.
Carey, Francis. Química orgánica, Madrid, McGraw-Hill,1999.
Revisa el uso de las mayúsculas en este informe.
Sabes que se emplean en títulos, subtítulos, al inicio de texto, en nombres propios; destacan las palabras y dan claridad al texto. Toma esto en cuenta al realizar tus informes y cualquier escrito.
Algo importante: si una palabra debe llevar tilde, hay que colocarla sin importar que sea mayúscula; ejemplo: Álvaro, Óscar, Álvarez Ábrego; es un error considerar que por ser mayúsculas no deben acentuarse gráficamente.
Una recomendación: procura no escribir textos en mayúscula sostenida; es decir, con todas las letras mayúsculas, pues esta forma de escritura es entendida como un grito al lector, creerán que estás enojado. Observa:
EL PROPÓSITO ES PRESENTAR LOS RESULTADOS DE LA COMPARACIÓN ENTRE DIFERENTES FRUTOS SECOS PARA CONOCER EL APORTE CALÓRICO DE CADA UNO.
Ahora observa:
El propósito es presentar los resultados de la comparación entre diferentes frutos secos para conocer el aporte calórico de cada uno.
¿Notas la diferencia? Con mayúsculas sostenidas se da la impresión de grito o agresividad. Es preferible no usarlas.
Algo más, ten presente que en Química y, seguramente, en tus informes, tendrás que utilizar los símbolos de los elementos. Éstos siempre se escriben con mayúscula y, en el caso de constar de más letras, éstas se escribirán con minúscula; ejemplos:
C carbono
H hidrógeno
O oxígeno
Ca calcio
Na sodio
Al igual que las fórmulas; observa algunos ejemplos:
CO2 H2SO4 NaCl H2O
Pero si lo que se requiere escribir es el nombre de dichos elementos y los compuestos, se debe usar minúscula: carbono, oro, hierro, dióxido de carbono, ácido clorhídrico, cloruro de sodio.
Observa unas palabras pequeñas que se escriben siempre igual, pero la diferencia es el acento:
porque–donde–cuando-como- que
En los informes y en muchos textos puede haber confusión respecto a si llevan o no acento escrito.
Es sencillo hacer la diferencia:
Si son preguntas o exclamaciones, se escriben entre los signos correspondientes y llevan tilde. Si no lo son, no la llevan.
¿Por qué? Es pregunta; se escribe separado y con tilde.
Porque es respuesta; se escribe junto y sin tilde.
¿Dónde?, ¿cuándo?, ¿cómo? y ¿qué? Son preguntas; llevan tilde.
Donde, cuando, como, que no son preguntas ni exclamaciones, no llevan tilde.
Recuerda: un informe de experimento científico es un documento serio, preciso. El lenguaje ha de ser formal y la escritura no debe dar lugar a interpretaciones erróneas. La ortografía es básica para elaborar un texto claro.
¿Y qué es recomendable para tener buena ortografía?
-Principalmente leer, porque ello familiariza con las palabras.
-Escribir, escribir y si existe duda acerca de cómo se escribe una palabra, consultar un diccionario.
-Es recomendable que conozcas las convenciones ortográficas, pero es más recomendable tener disposición para escribir bien, ser buen observador de las palabras escritas en libros, periódicos, revistas. El aprendizaje de la ortografía requiere mucha reflexión y una buena dosis de cariño a nuestro idioma.
El Reto de Hoy:
Toma un informe que hayas realizado de algún experimento en tu clase de Química o de Física o Biología. Lee con detenimiento y subraya las palabras en cuya ortografía tengas duda; consúltalas en el diccionario; corrige.
Busca en tu libro de texto un ejemplo de informe de experimento; ubica algunas palabras que en esta sesión repasaste, observa su escritura. Escríbelas en tu cuaderno.
Y de hoy en adelante, cuando tengas que elaborar un informe de experimento u otro tipo de texto, aplica lo aprendido en esta sesión.
Recuerda:
Escribir es mucho más que unir palabras: ¡Cuida tu ortografía!
Descarga tu clase dando clic aquí
¡Buen trabajo!
Gracias por tu esfuerzo.

Compra en Amazon
Sólidos de revolución
Aprendizaje esperado: Resuelve problemas que implican calcular el volumen de cilindros y conos o cualquiera de las variables que intervienen en las fórmulas que se utilicen. Anticipa cómo cambia el volumen al aumentar o disminuir alguna de las dimensiones.
Énfasis: Estudiar los sólidos de revolución.
¿Qué vamos a aprender?
Los materiales que vas a necesitar en esta sesión es tu cuaderno, lápiz y goma.
La siguiente carta es de una alumna de tercero de secundaria. Su nombre es Romina y dice que hace un par de días vio un programa en televisión. En el cual una atleta de patinaje artístico sobre hielo realizaba giros con su cuerpo, apoyada en una sola pierna y flexionando la otra.
Romina escribió que, al ver a la patinadora realizar movimientos en distintas posiciones, logró formar en el aire algunos cuerpos geométricos. Tanta fue su impresión que consiguió una fotografía de una patinadora profesional y la envió junto con su carta.

Esa patinadora es toda una profesional. Flexionar así sus piernas no es nada sencillo.
Con mucho entrenamiento y disciplina se puede lograr.
Pero ¿qué es lo que más le impresiona a Romina del movimiento de la patinadora?
Las figuras que se forman durante su giro. Puedes imaginar a la patinadora cuando está girando, pero no se ven figuras.
Observa de nueva cuenta la fotografía:

Si girara hacia la derecha —utilizando como eje de rotación la punta de su pie—, ¿queÌ cuerpo geométrico generaría con su movimiento?
Si gira hacia la derecha. imagina Se formaría una esfera.
Al igual que tú, Romina se interesó mucho, e investigó algunas posiciones y movimientos básicos del patinaje artístico.
Hizo los trazos correspondientes para poder anticipar queÌ cuerpos se generan en el aire con los giros.
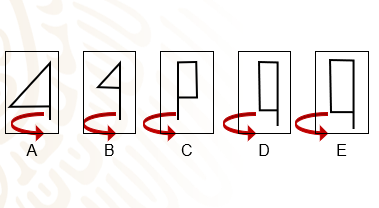
Estos son los trazos de Romina.
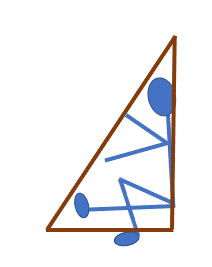
A B
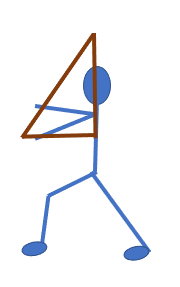
Se observa que en el trazo A, la patinadora gira su cuerpo hacia la derecha, apoyada en una sola pierna y poniendo en posición horizontal la otra pierna. Romina visualiza que esa pierna horizontal —junto con los brazos y el cuerpo de la patinadora—, forman un triángulo rectángulo perfecto.
En los siguientes trazos, Romina dibujó tres diferentes posiciones, a las cuales se llaman posiciones C, D y E.
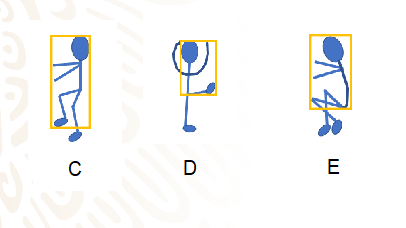
¿Qué figura geométrica trazó Romina sobre cada uno de los esquemas que representan a la patinadora?
Un rectángulo en cada una. A diferencia de los triángulos rectángulos que trazó en los esquemas A y B.
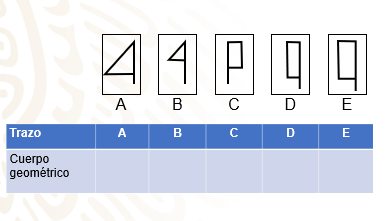
Dibuja sólo las figuras geométricas visualizadas en los esquemas A, B, C, D y E de los trazos de Romina.
En estas figuras geométricas se nota que las figuras A y B corresponden a triángulos rectángulos, mientras que las figuras C, D y E a rectángulos.
Si estas figuras geométricas se hicieran girar en torno a su eje, ¿qué cuerpo geométrico se genera?
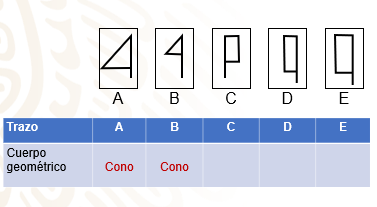
Si se giraran los primeros dos triángulos rectángulos, se conseguirían conos.
Y ¿qué cuerpo geométrico se forma al hacer girar cualquiera de los rectángulos sobre el eje que está dibujado?
Se forma una especie de tubo, es un, un cilindro
Con toda esta información, se realiza una tabla que contenga el trazo y el cuerpo geométrico que se consigue al girar sobre un eje.
La tabla incluye el cuerpo geométrico generado y su trazo correspondiente.
¿Qué cuerpo geométrico se genera al hacer girar sobre su propio eje a un triángulo rectángulo? Como los tipos A y B.
Se genera un cono.
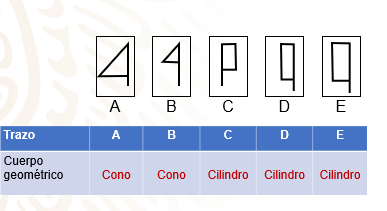
Y ¿qué cuerpo geométrico se genera al girar sobre uno de sus lados un rectángulo como los de las figuras C, D y E.
Un cilindro.
En cuanto a los trazos de los triángulos rectángulos A, B y C, generan un cono al girarlos.
Mientras que los trazos de los rectángulos C, D y E generan un cilindro al girarlos.
En el caso de los triángulos, es posible generar conos si los triángulos son de diferente tamaño, sin importar su tamaño.
Y de igual manera puedes cambiar la medida sin importar el tamaño de los rectángulos de la base como de la altura, y al girar, se genera un cilindro.
Valida si se forman los cuerpos que registraste en la tabla.
Para llevar a cabo esta actividad, se utiliza una hoja en blanco, un popote o un palito de madera, tijeras y cinta adhesiva.
En el papel. traza tres triángulos rectángulos como los de la siguiente imagen y con las medidas que se prefieras. Recorta los triángulos rectángulos para luego pegarlos al palito del lado del cateto a.
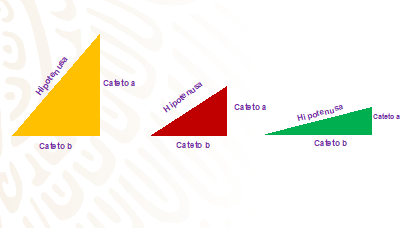

Se gira el palo al que se pegó cada triángulo rectángulo para comprobar lo siguiente:
¿se reconoce qué cuerpo geométrico se formó al girar cada triángulo rectángulo sobre su eje?
Observa cómo se genera el cono
Después, se registra en la tabla las características del cuerpo geométrico que se forma.
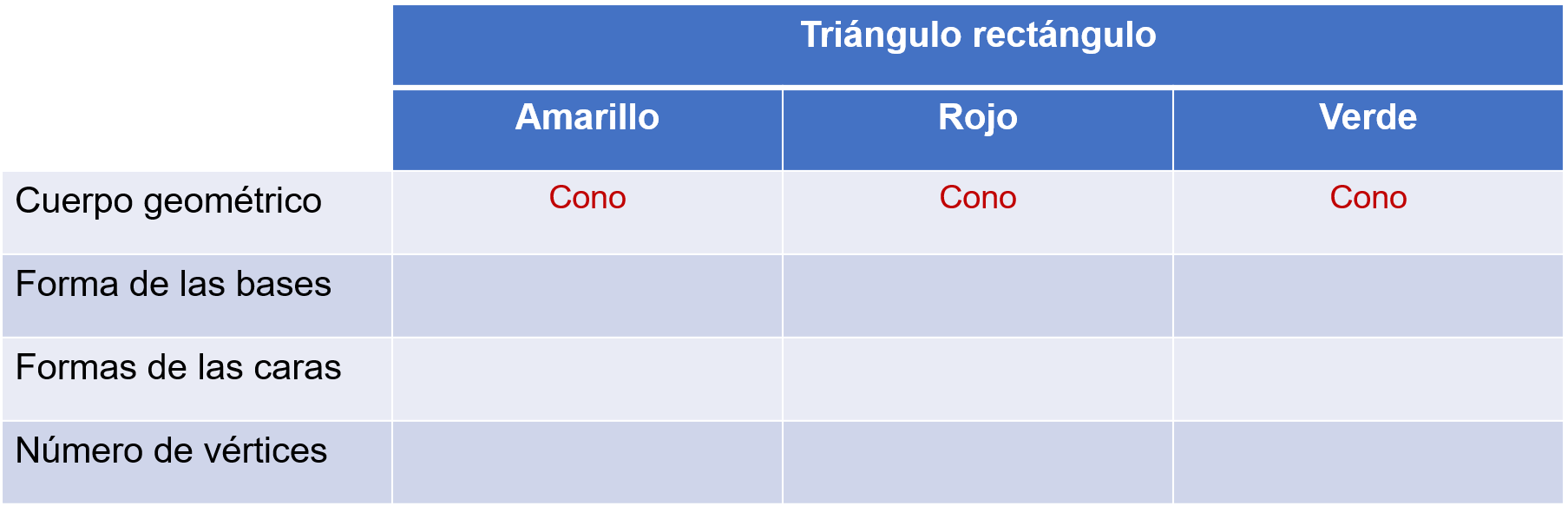
¿Qué cuerpo geométrico se generó al girar los triángulos rectángulos amarillo, rojo y verde sobre uno de sus catetos?
Un cono.
¿Y cuál es la forma de la base de cada cono generado?
Un círculo
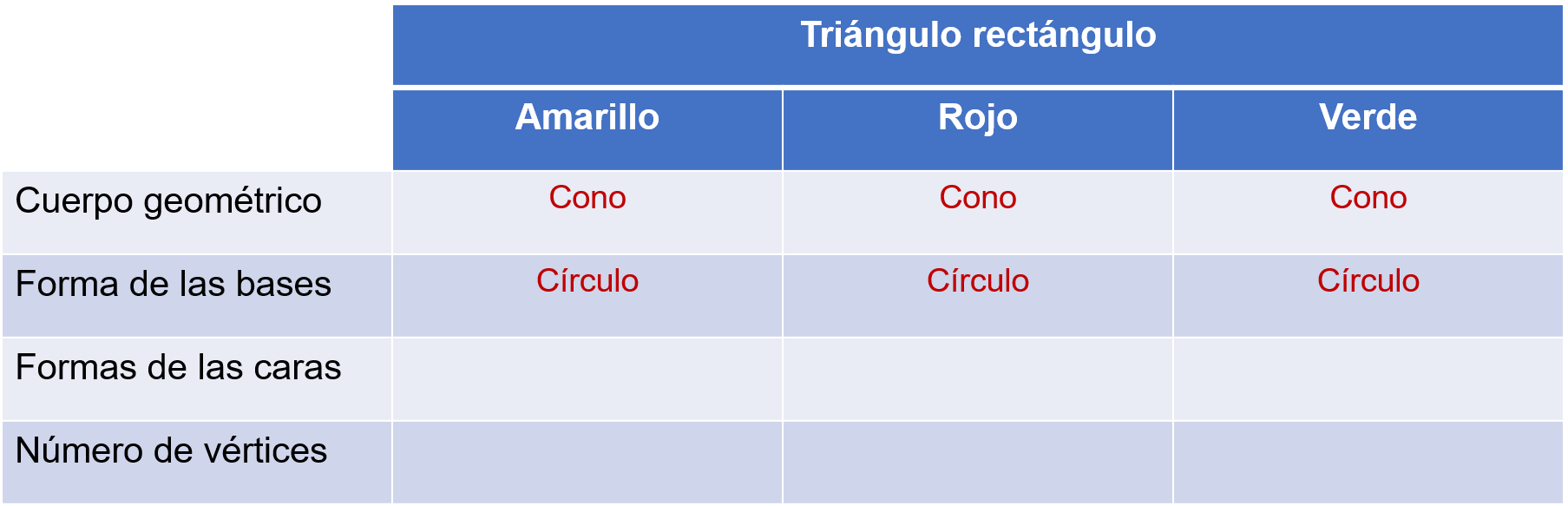
No tiene este cono caras laterales.
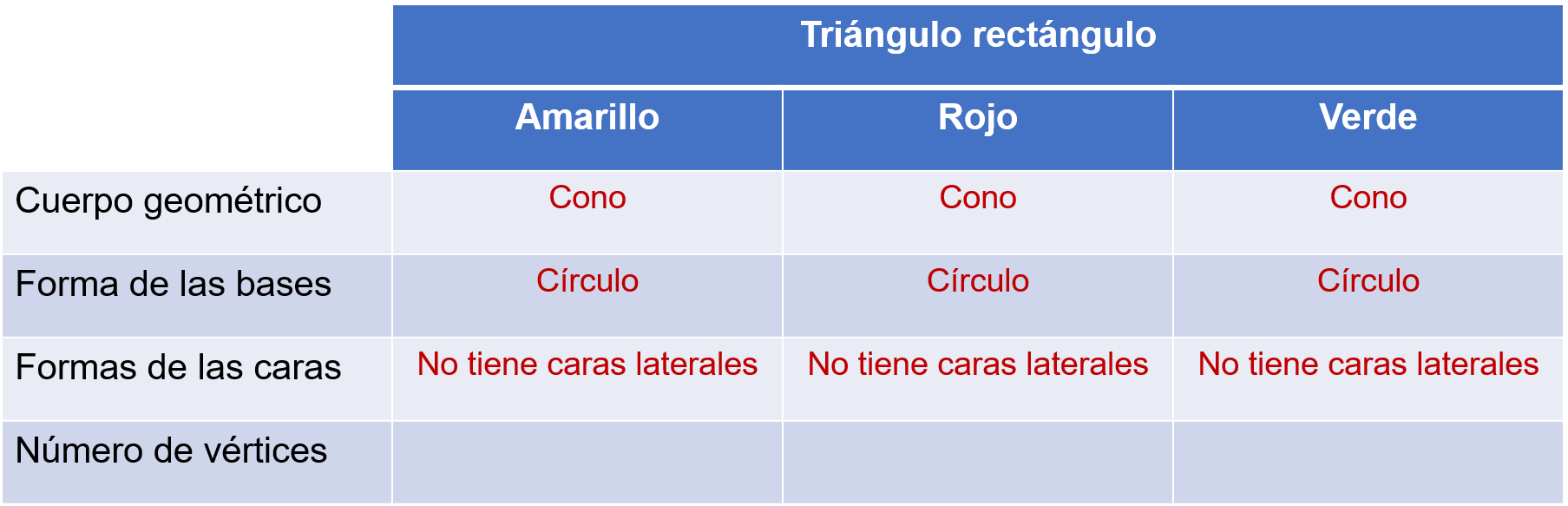
El cono tiene un solo vértice.
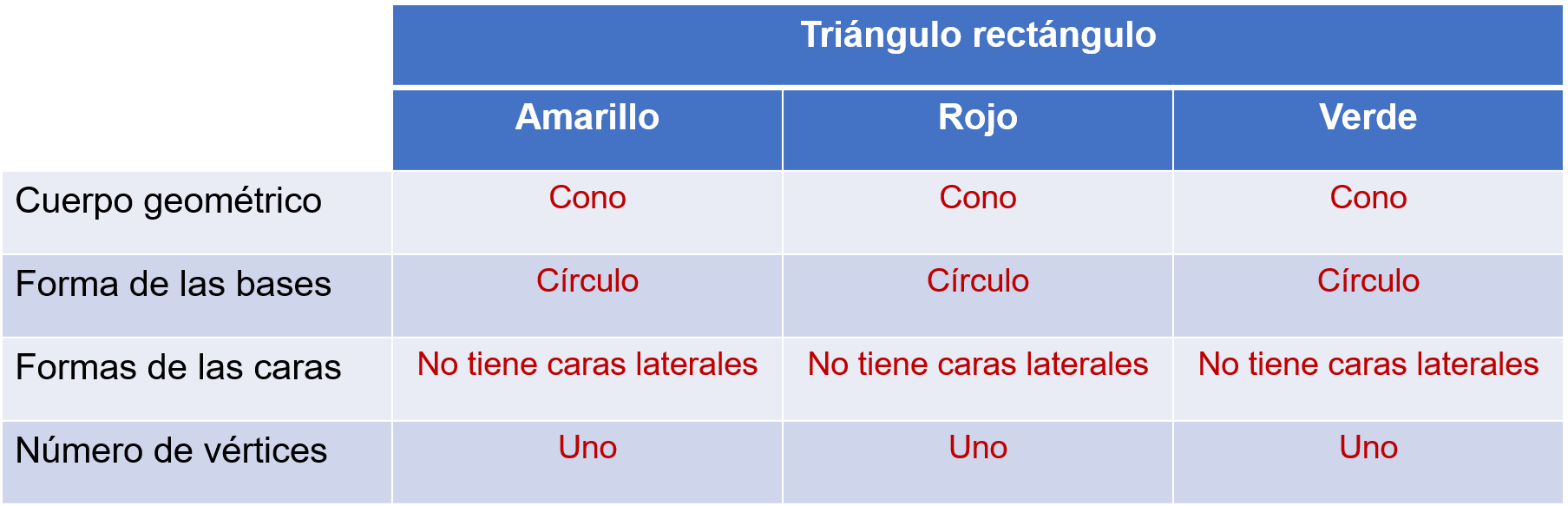
Es correcto afirmar que, al girar un triángulo rectángulo pegado a uno de sus catetos se forma un cono
Comprueba qué es lo que Romina imaginó al ver la fotografía de la patinadora.
En la fotografía original trazó un arco y en la copia, un semicírculo. Luego trazó un arco y una semicircunferencia en una hoja de papel, los recortó y pegó cada uno por el eje de cada figura a un popote para comenzar a girarlos.

El cuerpo geométrico obtuvo Romina con este movimiento para el arco fue un óvalo
Y el cuerpo geométrico que se generó al rotar la semicircunferencia fue una esfera.
¿Qué hacemos?
Registra en una tabla las características de los cuerpos geométricos generados.
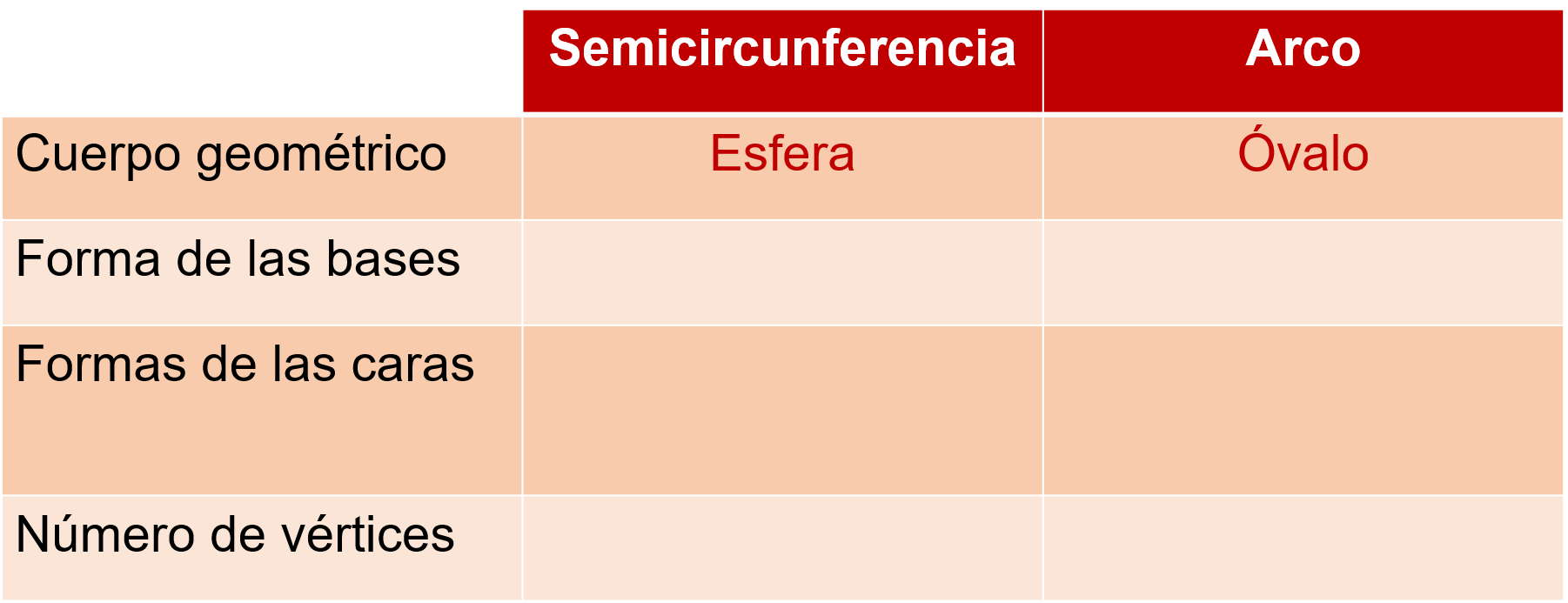
¿Cuál es la forma de la base, al girar tanto el arco como de la semicircunferencia?
Ninguna, porque no tienen base.
¿Cuál es la forma de las caras?
Tampoco tienen caras laterales.

¿Y qué se dice del número de vértices de cada figura generada?
Que ninguna de las dos tiene vértices.
Antes de continuar se concluye lo siguiente:

Un dato relevante: ¿sabías que a estos tres cuerpos geométricos se les llama sólidos de revolución?

Los cuerpos de revolución son aquellos sólidos que se obtienen al girar una figura plana alrededor de un eje de rotación. Es decir, son los cuerpos que se generan al rotar una región del plano alrededor de una recta.
El cilindro, el cono y la esfera son sólidos de revolución.
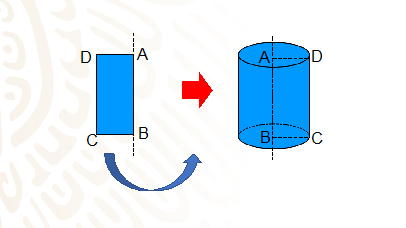
El cilindro es el cuerpo generado por un rectángulo que gira alrededor de uno de sus lados. En el esquema observa que el lado AB es el eje de giro o eje del cilindro, y es la altura del sólido.
El lado CD produce la superficie lateral del cilindro y se denomina generatriz.
Y de los lados AC y BD resultan dos círculos que son las bases del cilindro.
El cono se obtiene al girar un triángulo rectángulo alrededor de uno de sus catetos. El cateto fijo es el eje del cono, y la longitud de este cateto es la altura. La rotación del otro cateto genera un círculo perpendicular a la altura y corresponde a la base del cono; la longitud de esta base es el radio del cono. La hipotenusa del triángulo que se rota es la generatriz. El punto de intersección de la generatriz con el eje se llama vértice del cono.
La esfera se obtiene al girar un semicírculo alrededor de su diámetro.
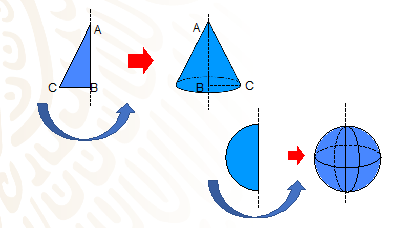
En los sólidos de revolución se llama generatriz a una línea puede ser recta, curva o una combinación de ambas, que al girar alrededor de otra recta llamada directriz, genera una forma geométrica conocida como sólido de revolución.
Y para entender estos conceptos, observa las siguientes figuras.
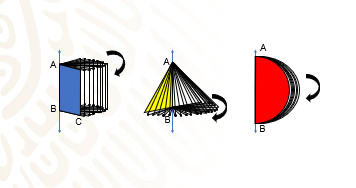
En estos ejemplos puedes observar que: el segmento DC en el rectángulo azul, el segmento AC en el triángulo amarillo y la línea curva AB del semicírculo rojo son todos ellos generatrices que al girar dan origen a un cilindro, un cono y una esfera.
Te puedes encontrar nuevas situaciones en las que se generen cuerpos de revolución. Por ejemplo:
Para hacer sus vasijas, un alfarero no sólo requiere la destreza de sus manos sino de la mezcla de barro y el torno.
Al girar el torno, el alfarero puede modelar la figura deseada con sus manos. En este caso:
¿qué figura está formándose al girar el barro? Te daré una pista: es un sólido de revolución.

La alfarería es una aplicación práctica de la que se consiguen sólidos de revolución a través de los giros sobre un eje determinado.
Otro ejemplo de la vida cotidiana está relacionado con una de las ceremonias de las culturas mesoamericanas: la ceremonia de Los Voladores, que se practica en algunas comunidades de los estados de Hidalgo, Puebla y Veracruz, aunque probablemente los más famosos sean Los Voladores de Papantla. ¿Los has visto alguna vez? A continuación, don Leopoldo hablará de esta práctica.
- Cápsula Don Leopoldo y los voladores de Papantla
Pero ¿cómo se sabe cuáles son estos sólidos.?

Se señalan los puntos A, B y C, de tal manera que BC es perpendicular a AC. Suponiendo que la cuerda no aumenta su longitud y al dar una vuelta, ¿qué trayectoria sigue el punto B al girar?
La trayectoria que sigue el punto B es una trayectoria circular.
La forma geométrica que describe el segmento BC mientras el volador gira alrededor del poste es un círculo
¿Puedes localizar en la fotografía el triángulo formado por los puntos A, B y C?
¿El triángulo ABC?,¿ya lo identificaste?
El cuerpo geométrico que se obtiene cuando el triángulo ABC gira alrededor del poste se llama cono.
Los sólidos de revolución se encuentran en distintos lugares. Pero ¿se pueden generar sólidos de revolución sin hacer girar una figura plana en torno al eje directriz?
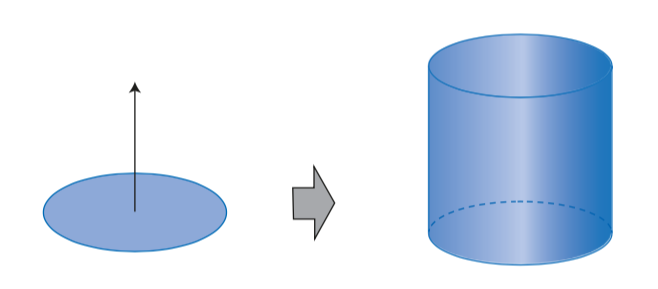
Ahora piensa en un cilindro. ¿Cómo puedes generarlo a partir de un círculo?
¿Un círculo que genera un cilindro?
¿Has visto esas bases que sirven para apilar discos compactos?
¿Qué sucede cuando sólo dejas un disco en el fondo de la base? Ese disco compacto tiene la forma de un círculo y si lo deslizas por todo el soporte si trasladas el disco en planos paralelos hasta llegar al tope del soporte, ¿cuál cuerpo geométrico se genera?

Se forma un cilindro.
¿Has visto el espectáculo que algunas personas realizan con burbujas de jabón?
En un documental una persona explicaba cómo se forman esas grandes burbujas de jabón.
Para formar una gran burbuja adentro de otra, se eleva un aro de cincuenta centímetros de diámetro lleno de espuma a partir del piso y en posición horizontal. De ese modo, se forma una gran burbuja alrededor de esa persona.
Suponiendo que el movimiento del aro siempre está alineado al cuerpo de la persona, ¿cuál sólido se forma? Se forma un cilindro, un cilindro de jabón.
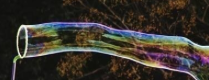
¿Y cuántas bases tiene ese cilindro? Tiene dos.
¿Se pueden generar conos y esferas con sólo trasladar una sección de esos sólidos de revolución?
Si trasladas la base de un cono hacia su vértice, no. No se genera un cono, se genera un cilindro. Si haces cualquier corte transversal a una esfera y ese corte lo trasladas a través del eje de simetría de la esfera, tampoco generas una esfera
No se pueden generar trasladando una sección transversal de un cono o de una esfera para formar el propio cono o esfera. Entonces, ¿qué sucede con el cilindro? ¿Acaso es especial?
El cilindro es un caso particular: se puede generar al hacer un movimiento de traslación de un círculo a lo largo de una recta perpendicular a la base, como en los dos ejemplos antes mencionados.
En esta sesión aprendiste que, a partir de figuras planas, como el triángulo rectángulo, el rectángulo y el círculo girando en torno a un eje, se generan los sólidos de revolución.
Observa “un dato por conocer”, traído por don Leopoldo, que subraya las 3 ideas que se aprendieron sobre los sólidos de revolución:
- Cápsula 2: Don Leopoldo
El Reto de Hoy:
Para resolver dudas o ejercitar lo aprendido, te puedes apoyar en tu libro de texto.
Descarga tu clase dando clic aquí
¡Buen trabajo!
Gracias por tu esfuerzo.

Compra en Amazon
¿Cuáles son las aportaciones del trabajo de Lewis?
Aprendizaje esperado: Explica la importancia del trabajo de Lewis en relación con su propuesta de que en el enlace químico los átomos adquieren una estructura estable.
Énfasis: Explicar y valorar la importancia del trabajo de Lewis en relación con su propuesta de que en el enlace químico los átomos adquieren una estructura estable.
¿Qué vamos aprender?
Lee la siguiente frase célebre de Ruy Pérez Tamayo, investigador y divulgador de ciencia mexicano.
"La verdad es que yo he definido la ciencia como una actividad humana creativa. Se requiere el mismo tipo de inspiración, de imaginación y de aventura del pensamiento que las otras profesiones creativas como son las artísticas".
Para comprender las propiedades y el comportamiento de la materia, los químicos emplean modelos. En esta sesión aprenderás las propuestas y aportaciones de Lewis que permitieron comprender mejor la forma en la que se unen los átomos para formar moléculas.
Para esta sesión necesitarás tu cuaderno, tu libro de texto, lápiz, colores y bolígrafo.
Las palabras o conceptos clave de esta sesión son:
- Modelo atómico cúbico
- Electrones de valencia
- Regla del octeto
- Diagrama de Lewis
- Gases nobles
- Estabilidad de átomos
¿Qué hacemos?
¿Alguna vez te has preguntado cómo es que los químicos propusieron las fórmulas de los compuestos químicos?
En sesiones anteriores aprendiste sobre el modelo atómico, las regularidades de la tabla periódica, electrones de valencia, enlaces y formación de compuestos, pues bien, en esta sesión retomarás estos conceptos.
Los químicos se han interesado siempre en estudiar la forma en que se unen los átomos ya que esto permite comprender a la materia, pero ¿cómo se representa a la materia para poder comprender estas uniones? ¿por qué el agua está formada por dos átomos de hidrógeno y uno de oxígeno? ¿no es posible que la molécula del agua se formara con 3 átomos de hidrógeno y dos de oxígeno?
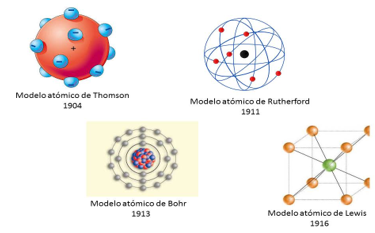
Ante este tipo de interrogantes los científicos utilizaron su conocimiento y creatividad, propusieron diferentes modelos para explicar la estructura de un átomo y cómo se realizaban las uniones entre ellos para formar sustancias nuevas.
En 1897, Thomson demostró la existencia del electrón y varios físicos y químicos no tardaron en considerar que esta partícula ofreciese alguna forma nueva de entender las uniones entre los átomos.
En 1904 cuando Thomson desarrolló una teoría atómica en la que los electrones podían circular en capas externas del átomo, en ese mismo año Abegg formuló una regla más explícita, “la regla del ocho” que correspondía con las regularidades periódicas.
Durante y después de la Primera Guerra Mundial, cuando Kossel y Lewis desarrollaron de manera independiente teorías electrónicas del enlace químico por compartición de electrones, un concepto que amplió con éxito Irving Langmuir.
Junto a Gilbert Lewis, Langmuir desarrolló la llamada teoría Langmuir-Lewis sobre las interacciones químicas y las valencias.
En esta nueva teoría en el segundo y tercer periodo de la tabla periódica se sitúan 8 elementos en cada uno, el de mayor número atómico de cada periodo tiene un “octeto de electrones” estable y que no interviene en enlaces, los gases nobles.
Los elementos anteriores a estos gases nobles del periodo 2 y 3 presentan en su última capa menos de 8 electrones, los electrones de valencia.
Langmuir distinguía que existe una transferencia de electrones (enlace iónico), además hay una compartición de electrones, en el que dos electrones, uno de cada átomo que formaba un enlace se compartían más o menos igualitariamente a lo que se denominó enlace covalente.
Langmuir trabajaba junto a una talentosísima científica llamada Katherine Blodgett cuando publicó sus aportaciones sobre el enlace covalente.
Y al mismo tiempo tanto Niels Bohr y sus colaboradores desarrollaron la teoría de la estructura electrónica de los átomos, usando las regularidades de la tabla periódica.
Las investigaciones, descubrimientos y estudios realizados por Lewis representaron un gran avance en la ciencia, especialmente en el área de química, fisicoquímica e ingeniería térmica.
Fueron tan trascendentales que aún en la actualidad se sigue enseñando el modelo cúbico por su simplicidad ya que, puede explicar de forma sencilla el enlace químico y cómo un par de electrones mantienen unidos a dos átomos. El fundamento del modelo son los pares electrónicos, la estabilidad de los compuestos se explica porque completan 8 electrones en su capa más externa. Su trabajo lo coloca entre los científicos más importantes de nuestros tiempos.
Las investigaciones de Gilbert Lewis fueron muy amplias, pero se hizo famoso por la teoría de los enlaces químicos y la definición del ácido –base que formuló en 1923 de la cual aprenderás en sesiones posteriores.
Lee la siguiente lista de las destacadas aportaciones de Lewis que estudiarás en esta sesión:
1.- El modelo del átomo cúbico
2.- La regla del octeto
3.- Los electrones periféricos
4.- El diagrama de Lewis
5.- Teorías de enlace covalente
El modelo atómico de Lewis fue uno de los primeros modelos atómicos que intentó explicar los electrones de valencia. El modelo cúbico atómico de Lewis, aunque diferente, es un predecesor del modelo atómico actual. Es importante aclarar que en esa época Thomson apenas había propuesto el electrón como una partícula que constituía los átomos y que en un lapso de tiempo muy corto también se estaba proponiendo el modelo de Bohr que “acomodaba” los electrones en capas y el modelo de Rutherford para el núcleo era muy reciente.
De acuerdo con el modelo cúbico de Lewis los electrones externos se hallan ubicados en los vértices de un cubo que representa un átomo.
En cada átomo hay una parte esencial que permanece inalterada en los cambios químicos llamada kernel y está formada por el núcleo, positivo y los electrones internos.
Los electrones de las capas externas son los que intervienen en las reacciones químicas y formación de enlaces.
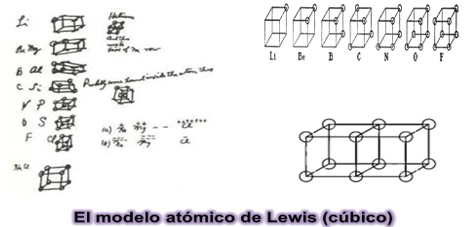
Por lo tanto, en el modelo cubico de Lewis, son los que se representan en los vértices del cubo. Estos son conocidos como electrones de valencia.
Se construyeron algunas representaciones del modelo cúbico atómico para que puedas observar lo que Lewis quiso demostrar con ellos, analiza cada uno.
- LITIO. El átomo de este elemento tiene un electrón de valencia. Entonces, en el modelo cúbico solo verás representado a ese electrón. Se coloca solo una esfera de unicel en uno de los vértices del cubo.
- BERILIO. El átomo de este elemento tiene 2 electrones de valencia, por lo tanto, debes colocar 2 esferas de unicel en los vértices del cubo.
- BORO. El átomo de este elemento tiene 3 electrones de valencia ¿cuántos electrones debes colocar en el modelo cubico que lo representa? Se deben colocar 3 esferas en los vértices para representarlos.
- CARBONO ¿Cuántos electrones de valencia tiene? Si cuentas vas a saber que son 4. Colocas el electrón de valencia
- NITRÓGENO. Los átomos de este elemento tienen 5. Se coloca el electrón de valencia
- El OXÍGENO cuenta con 6 electrones de valencia, es decir, que sólo le faltan 2 para completar su capa de valencia. Colocas el electrón de valencia
- El FLÚOR es el elemento que tiene 7 electrones de valencia y solo le falta 1 para ser estable como el gas noble llamado neón.
Los átomos de los gases nobles son estables debido a que su capa más externa está completa. Cabe señalar que el helio tiene su capa completa, porque al encontrarse en el primer periodo tiene el número máximo de electrones que son 2. Sin embargo, no cumple con la regla del octeto, debido a que está menciona que deben completarse ocho electrones en la capa de valencia.
La representación de los gases nobles como el Neón, Argón, Kriptón, Xenón y Radón mediante el modelo cúbico de Lewis quedaría de esta manera.
Todos los vértices están ocupados y si sumas cada electrón te va a dar un total de 8, que es el máximo de electrones que puede haber en la capa de valencia de los átomos, como se ilustra en el modelo que estás revisando.
Gilbert N. Lewis estableció por medio de su modelo cúbico que los átomos tienden a formar enlaces compartiendo un par de electrones hasta completar su capa de valencia uniéndose con átomos iguales o diferentes, es decir, con otros elementos químicos.
El enlace iónico se forma por la atracción electrostática que se genera cuando un átomo dona un electrón al otro, generándose así uno fuertemente electropositivo y otro fuertemente electronegativo que son atraídos mutuamente.
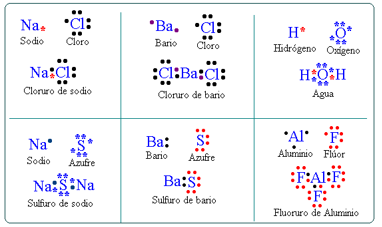
Como ejemplo usarás el compuesto de cloruro de sodio (sal común).
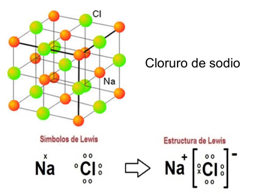
El átomo de cloro tiene 7 electrones de valencia y el de sodio tiene solo 1, como al cloro le falta solo uno para completar su capa de valencia, el átomo de sodio cede su único electrón de valencia para que el cloro logre la estabilidad. Se quedan unidos por medio de la fuerza electrostática que se genera formando el ion sodio y el ion cloro.
En los enlaces covalentes se comparten pares de electrones de valencia. Revisa el siguiente ejemplo: HCl, el ácido clorhídrico se compone de un átomo de hidrógeno y uno de cloro. Recuerda que el hidrógeno es estable sólo con 2 electrones de valencia por encontrarse en el primer periodo.
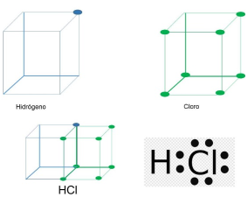
El átomo de hidrógeno posee un electrón de valencia mientras que el cloro tiene 7, el hidrógeno y cloro comparten un par de electrones, como puedes observar en este modelo cúbico de Lewis.
Con este modelo Lewis también propuso la formación de un enlace doble, formado por medio de la compartición de dos pares de electrones, lo representó de la siguiente forma.
Con este modelo, en este enlace covalente se comparten 2 pares de electrones de valencia, es decir una cara de los cubos y ambos completan sus 8 electrones. Este ejemplo se puede usar para representar la unión de la molécula de oxígeno.
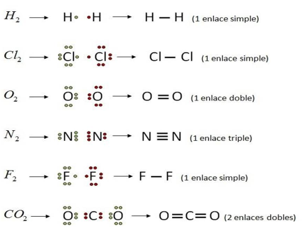
Aunque útil para la comprensión de la formación de ciertos enlaces, el modelo cúbico tiene una limitante, no es útil para representar un triple enlace, como el del monóxido de carbono, Posteriormente se desarrolló el diagrama de Lewis, también llamada diagrama punto, útil para representar la formación de enlaces sencillos, dobles y triples.
¿Qué son los electrones de valencia? Son los electrones que se encuentran en la capa más externa del átomo, siendo estos los responsables de la interacción entre átomos para la formación de enlaces.
Los electrones en las capas o niveles externos son aquellos que participan en los enlaces químicos para la formación de moléculas de elementos o compuestos, así como de compuesto iónicos.
Lewis contribuyó en el desarrollo de la regla del octeto, aunque él no la propuso, pero con ello se puede comprender la formación de compuestos, ¿qué establece esta regla?
Gilbert N. Lewis estableció en 1916 la teoría del enlace químico en la que se establece la tendencia de los átomos para completar su último nivel de energía, la capa de valencia, con una cantidad de 8 electrones, al compartir un par de electrones que forman un enlace covalente.
Lewis y Langmuir enunciaron la regla del octeto al observar la manera en que se combinan entre sí los elementos. Así, advirtieron que todos tienden a la configuración estructural del gas noble más cercano en la tabla periódica.
Por propiedades propias de algunos elementos y como toda regla tiene excepciones, quedan excluidos el oxígeno, el hidrógeno, el nitrógeno, el carbono, el aluminio, el berilio, el boro, el flúor, el fósforo y el azufre, que se organizan de manera diferente para conseguir la estabilidad en sus compuestos.
Sin embargo, la regla del octeto es útil para predecir el comportamiento de muchas otras sustancias ya que al estar unidos los átomos adquieren una situación más estable al tener 8 electrones en su capa externa.
Lewis, en 1916, presentó a la comunidad científica un modelo sencillo para representar los electrones de valencia, tanto los que participan en la formación de enlaces como los que no, en una molécula.
Aunque es una representación sencilla, pues no refleja la geometría de la molécula, permite saber cuántos electrones de valencia interactúan, formando enlaces simples, dobles o triples.
Se refiere al diagrama de Lewis, útil para representar átomos y moléculas donde el símbolo del elemento se rodea con puntos que representan los electrones en la capa de valencia.
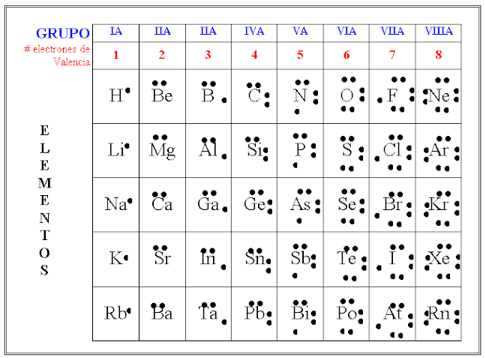
¿Notas algo en común entre los elementos de los grupos de la tabla periódica? ¿Cuántos electrones de valencia tienen los elementos del grupo 14? ¿Y los del grupo 17?
Como ya has visto, la posición de los elementos en la tabla periódica ayuda a conocer sus propiedades. Aquí puedes ver que el grupo en el que se encuentra el elemento refleja, entre otras cosas, el número de electrones en la capa de valencia.
Si el grupo 14 tiene 4 electrones de valencia y el grupo 17, 7 electrones de valencia, ¿podrías dibujar la estructura de Lewis del carbono y del flúor? El carbono con 4 puntos y el flúor con 7 puntos como se muestra en la imagen.
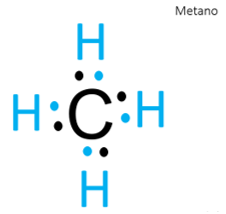
Dibuja la estructura de Lewis con el metano. La fórmula química es CH4, es decir que tiene un átomo de carbono y 4 átomos de hidrógeno, así es, el carbono tiene 4 electrones de valencia por estar en el grupo 14 de la tabla periódica y el hidrógeno, está en el grupo 1, tiene 1 electrón de valencia, dibuja cuatro átomos de hidrógeno con un su electrón respectivo a cada uno de ellos, ahora acomódalos cerca del carbono para formar pares de electrones.
Es muy importante entender cómo interactúa la materia para identificar su estructura, propiedades, y asimismo los riesgos para el medio ambiente y el hombre.
Conoce una tragedia que sucedió hace más de 80 años.
La tragedia del Zeppelin Hindenburg.
El 6 de mayo de 1937, el Hindenburg, orgullo de la flota de dirigibles de la Alemania nazi, estalló en llamas en el cielo de Nueva Jersey cuando iba a realizar las maniobras de ataque. Esta tragedia marcó el final de la era dorada de los zepelines.
El enorme zeppelín llegó a cruzar 17 veces el océano Atlántico, recorriendo más de 308.000 kilómetros.
El zeppelín Hindenburg surcó los cielos de Berlín durante la inauguración de los Juegos Olímpicos de 1936.
Una chispa prendió en el dirigible Hindenburg y en menos de un minuto cayó envuelto en fuego. De las 97 personas que viajaban en el Hindenburg, murieron 35, 13 pasajeros y 22 tripulantes. El accidente ocupó las portadas de los periódicos de la época.
¿Pero qué fue lo que ocasionó este trágico accidente?
El Zeppelin fue considerado un palacio flotante, compitiendo con el lujo del Titanic. Fue diseñado para contener un gas noble nombrado helio, pero aquel día su contenido no fue este gas sino otro, hidrógeno, el cual es muy reactivo dado que se une con otros átomos produciendo nuevos compuestos, se dice que los ingenieros alemanes decidieron emplear hidrógeno porque las reservas de helio estaban acaparadas.
Si el Zeppelin hubiese contenido el gas noble helio, aquel desastre no hubiera ocurrido dado que este elemento es muy poco reactivo con otros átomos, ya que su estructura es estable, de hecho, se le conoce también como un gas inerte por esta condición.
Observa la siguiente cápsula del minuto 03:00 al 04:45, que explica la estabilidad de los átomos:
- Átomos estables
Como pudiste observar en el video, en general, los átomos tienden a completar su capa más externa para que las moléculas sean estables.
Los elementos se encuentran en un determinado lugar dentro de la tabla periódica, indicando los electrones de valencia de su última capa o nivel de energía, pero sabían también que estos indican la cantidad de enlaces que pueden llegar a formar.
El hidrógeno, por ejemplo, sólo puede formar un enlace sencillo porque se encuentra en el grupo 1 de la tabla periódica. Se encuentra como una molécula diatómica, es decir, que se unen dos átomos de hidrógeno por medio de un par de electrones. Su unión se representa de la siguiente manera utilizando la estructura de Lewis.
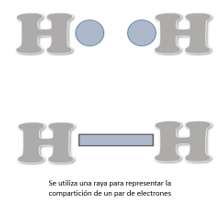
También se puede representar con una raya la compartición de un par de electrones.
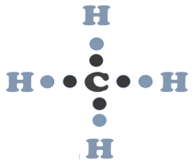
En el caso del carbono este elemento se encuentra en el grupo 14, por lo tanto, tiene 4 electrones de valencia e indica que puede formar cuatro enlaces.
Por ejemplo, cuando dibujaste el metano pudiste observar que cada átomo de hidrógeno logra hacer un enlace sencillo, mientras que el átomo de carbono es capaz de formar cuatro enlaces sencillos compartiendo sus 4 electrones de valencia.
¿Notas alguna similitud en las siguientes fórmulas químicas H2O, H2S?

Los átomos de estos compuestos se unen por medio de dos enlaces sencillos, el oxígeno y el azufre forman dos enlaces sencillos compartiendo dos de sus electrones para completar 8 en su capa de valencia.
Para representar una molécula con la estructura o diagrama de Lewis debes seguir ciertas reglas, las cuales son:
- Contar los electrones de valencia de todos los átomos de la molécula.

- Debes elegir el átomo central, buscando al que sea menos electronegativo. La excepción a esta regla es el hidrógeno, ya que éste sólo puede tener dos electrones rodeándolo.
- Dibujar al átomo central con sus electrones de valencia alrededor. Tomar en cuenta la carga, en el caso de tratarse de un ion.
- Dibujar el resto de los átomos rodeando al átomo central, con un electrón de valencia del átomo central emparejado con un electrón de valencia del átomo secundario.
- Contar el número de electrones alrededor de cada átomo. Éstos deben cumplir la regla del octeto, quiere decir que deben tener ocho electrones de valencia rodeándolos. Esta regla no aplica para el hidrógeno, litio y berilio, los que deben estar rodeados por dos electrones según la regla del octeto.
- No siempre se puede cumplir estas reglas con enlaces simples, es en estos casos que se van agregando enlaces dobles o triples a la molécula
La estructura o diagrama de Lewis es una representación que muestra los enlaces entre los átomos de una molécula, así como los pares de electrones solitarios, es decir aquellos que no forman parte del enlace.
Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros formando enlaces ya sea simples, dobles, o triples.
Ahora llevarás a cabo una actividad para aplicar el contenido.
Realiza un ejemplo para disipar dudas (usar símbolos y electrones hechos con hojas de color).
El dióxido de carbono CO2, se utiliza como agente extintor, ya que elimina el oxígeno encontrado en ese espacio, e impide que se genere una combustión. En la industria alimentaria se utiliza en bebidas carbonatadas para darles efervescencia.
El símbolo de Lewis del carbono se representa con una letra C mayúscula acompañada de 4 electrones de valencia.
Mientras que el oxígeno se representa con la letra mayúscula O acompañada de 6 electrones de valencia.
Recuerda que en una sesión anterior aprendiste cuáles son los colores con los que se representan los átomos, por eso el carbono está en negro y el oxígeno en rojo.
Ahora falta representar el diagrama de Lewis de la molécula, tienes que colocar al carbono en el centro y los dos oxígenos a un costado para que se pueda representar el enlace.
Posteriormente colocas los electrones de valencia al carbono, si revisas en la tabla periódica, observas que el carbono pertenece al grupo 14 y por lo tanto tiene 4 electrones de valencia, sitúa 2 del lado derecho y dos del lado izquierdo, después tienes que colocar los electrones de valencia de cada átomo de oxígeno, recordando que el oxígeno se encuentra en el grupo 16, deduce que tiene 6 electrones de valencia, para el primer átomo alinea 2 con los del carbono y los demás los sitúas en parte superior y de lado izquierdo, ahora haces el mismo procedimiento con el segundo átomo de oxígeno.
Para saber si el diagrama de Lewis está correcto tienes que contar los electrones, recuerda que se tiene que cumplir con la regla del octeto.
El primer oxígeno forma un enlace doble con el carbono, por lo tanto, están compartiendo dos pares de electrones, si los sumas, sabrás que son 4 más 2 de la parte superior, van 6 y dos más que están de lado izquierdo, efectivamente tiene 8 electrones de valencia. Continua con el carbono, este átomo se encuentra compartiendo 2 pares de electrones con cada oxígeno, si sumas 4 más otros 4 son los 8 electrones de valencia que debe tener. Ahora sumas los electrones del segundo átomo de oxígeno 4 de dos pares de electrones que comparte con el átomo de carbono más 2 de la parte superior más 2 del lado derecho suman 8.
Esta molécula es estable porque las capas de valencia de los átomos que la forman están completas con sus 8 electrones.
Ahora comprueba lo aprendido a través del siguiente ejercicio:
Representa en tu cuaderno el diagrama de Lewis de las siguientes moléculas utilizando una tabla como se ejemplifica. En ella tienes que escribir molécula, uso común, los símbolos y el diagrama de Lewis. Las moléculas son amoniaco, acetona y agua.

Si tienes alguna duda puedes consultar con tu maestro.
Se te sugiere consultar la siguiente página electrónica donde encontrarás actividades interactivas que puedes trabajar con tu maestro o maestra para aprender jugando a través de esta plataforma.
http://www.objetos.unam.mx/quimica/simbolosLewis/index.html
¿Sabías qué? El carbono es un elemento químico que puede formar muchos compuestos al unirse con más carbonos y algunos otros elementos. Asimismo, el carbono en estado sólido, puede adoptar muchas formas alotrópicas, por ejemplo, más baratos el carbón; más blandos el grafito; más caros y a la vez más duros el diamante. El grafeno forma láminas onduladas del grosor de un átomo (0.1 nm), con una resistencia y conductividad eléctrica excepcionales.
Tanto el carbón, el grafito, el grafeno y el diamante, están formados solo por átomos de carbono. La diferencia está en la estructura cristalina de cada uno, que a su vez se debe al tipo de enlaces que forma.
Actualmente si tienes que salir, al volver a casa o entrar a un lugar pisas una disolución de agua con cloro, que por cierto no es cloro, pues el cloro en su estado natural es un gas de color amarillo limón, sino Hipoclorito de sodio NaClO ¿por qué o para qué se hace? En principio, este hábito podría ayudar a disminuir los microorganismos patógenos en la suela de los zapatos, ya que el hipoclorito de sodio actúa sobre los microorganismos a nivel celular, rompiendo la estabilidad de los enlaces que conforman la membrana del microorganismo, ocasionando su muerte. Este es solo un ejemplo de cómo la química se encuentra en la vida cotidiana.
Aunque fue nominado 42 veces, Lewis nunca ganó el Premio Nobel de Química.
Durante esta sesión aprendiste sobre los trabajos de Lewis y te encontraste que lo planteado por él tiene alcances, pero también limitaciones, y por ello las conocerás para concluir con este tema.
Entre las aportaciones encuentras:
- El modelo de Lewis representa los electrones de valencia del átomo.
- La regla del octeto identifica la cantidad de electrones necesarios para que un átomo complete su capa de valencia de 8 electrones.
- El modelo de par electrónico permite identificar cómo se forma el enlace covalente.
Las limitaciones son:
- El modelo de Lewis no proporciona información sobre el tipo de enlace entre átomos, los electrones no se encuentran en los vértices de un cubo y los electrones no están inmóviles.
- La regla del octeto no aporta información acerca el tipo de enlace que se forma entre los átomos para completar su capa de valencia.
- El par electrónico no explica la formación de los enlaces iónicos.
El Reto de Hoy:
Se te recomienda que visites la siguiente liga donde encontrarás información de la Doctora Katharine Blodgett, quien trabajó al lado de Langmuir y estudió su doctorado en el laboratorio Cavendish de la Universidad de Cambrige, Universidad en la que Rutherford realizaba sus investigaciones.
https://mujeresconciencia.com/2018/11/13/katharine-burr-blodgett-1898-1979/
Descarga tu clase dando clic aquí
¡Buen trabajo!
Gracias por tu esfuerzo.

Compra en Amazon
¿Que mis ancestros hicieron qué?
Aprendizaje esperado: Representa eventos históricos de la humanidad mediante distintas formas expresivas.
Énfasis: Involucrar a las personas de su familia para conocer hechos históricos que transformaron su vida y los representa con elementos del arte.
¿Qué vamos aprender?
En sesiones pasadas has aprendido sobre las emociones en el arte, las has construido como parte de tu historia y como una parte fundamental de expresar a través de varias disciplinas artísticas.
Pero, ¿cómo se construye una historia?
Puede ser a partir de un personaje. Primero se le da un nombre, se le otorga un lugar, un contexto social y cultural y desde ahí se inicia a contar la historia.
¿Sabes que es un árbol genealógico? Con él se trata de rescatar una historia que te permita acercarte a tus orígenes, por eso colocas las fotos de tus familiares.
Entonces el árbol genealógico es la representación gráfica en la que muestras a tus ascendentes y descendientes.

Pero la idea es que realices el tuyo de una forma significativa, utilizando elementos de las artes y pensando en los árboles de la vida que hacen en Metepec, por ejemplo.

¿Qué hacemos?
Lo primero que necesitas hacer es platicar con tus familiares mayores, pueden ser tus papás, tíos, abuelos o con quienes tengas cerca.
Una vez que tengas tu historia, junta papel, cartulinas o cartón para realizar los bocetos de tus ancestros.
Pero antes de dar inicio es necesario que aprendas un poco sobre el árbol de la vida.
El árbol de la vida es un símbolo vital y regenerador que aporta esperanza y fortaleza. Las raíces suelen simbolizar el origen y la fuerza interior, la cual debe ser sólida y resistente. El tronco simboliza la vida misma y se extiende entre el pasado y el futuro lleno de hojas y frutos.
Un árbol de la vida siempre es una manera de desear buena suerte, es una forma de recordar que no serías lo que eres si no hubieses sido diferente antes. Que es el pasado el que nutre tu presente para que puedes forjar tu futuro.
Una semilla que ha arraigado bien en la tierra dando lugar a un árbol frondoso con fuertes raíces y ramas que se extienden hacia arriba, si sabes cómo elegir lo que te va a nutrir sabiamente, tu árbol de la vida crecerá más fuerte y lleno de frutos.
El árbol de la vida es originario de Metepec y los artesanos transmiten sus costumbres de generación en generación a través de este árbol de la vida.
Puedes ir creando tu propio árbol de la vida, puedes ayudarte de algunas preguntas como: ¿de dónde viene mi familia?, ¿qué eventos históricos en mi familia les ha cambiado la vida? Comienza por tus antepasados.
Revisa el siguiente ejemplo:
Mis abuelos paternos son de Oaxaca y por ende mi papá también. Por parte de mi mamá, mi abuelo era de Guadalajara y mi abuela del entonces Distrito Federal. Mi papá y mi mamá se conocieron aquí en la ciudad. Por eso voy a usar un vestuario para mostrar esa mezcla de tradiciones en mi familia.
Realicé una nopalera con metal y papel de colores. En la casa de mis abuelos no faltaban los nopales y, por supuesto, las tunas. Eran la comida y el postre.
Saben, mi mamá me contó que una vez me extravié en la casa cuando era pequeña. Mi papá y mi mamá me buscaron desesperados. Hasta que a mi mamá se le ocurrió mirar a la azotea. Y ahí estaba yo, sentada en la orilla de la marquesina. Mi papá subió por mí. Siempre fue mi héroe.
Por eso voy a agregar eso en el árbol ya que me recuerda ese evento.
Colocaré algo que represente mi nacimiento, podría ser en esta nopalera con el celofán de distintos colores represento la fuerza y la luz que cada uno me regaló e hizo posible mi nacimiento.
La historia y costumbres de mi familia son las raíces de mi origen.
Algunos de ellos eran buenos para sembrar, cantar, bailar, cocinar y hasta para jugar a la lotería.
Desde que tengo memoria dibujo. Mi contacto con las artes me ha permitido enriquecer mi vida y compartirlo. Por eso este dibujo estuvo inspirado en los animales que criaba mi familia; algo así dibujé cuando tenía 12 años, y desde entonces descubrí mi pasión por el dibujo.
Con este ejemplo puedes darte una idea de cómo realizar tu árbol, ¿qué has descubierto entre las historias de tu familia?
¿Cómo le llamarían a tu árbol de la vida? ¿Qué significa para ti?
Conocer tu historia te ayudará a sentirte orgulloso de tu identidad; al igual que el árbol, pues si las raíces son fuertes y profundas, el árbol crecerá más y más, hasta alcanzar el cielo.
Por ejemplo, algún día podrás platicar a tus familiares futuros lo que viviste en esta pandemia. Y una forma de representarlo podría ser con un cubrebocas al que le dibujaré un corazón.
Son increíbles las diversas formas de construir un árbol de la vida.
Recuerda realizar bocetos que te permitan, al final, tener tu creación definitiva.
Debes lograr involucrar eventos importantes de tu historia familiar y es mejor que lo hagas utilizando elementos de las artes.
Si es posible observa el programa Aprende en Casa III, porque estará como invitado el especialista en danza folclórica Luis Santiago, y compartirá su danza del árbol de la vida.
Su performance consiste en que contará un poco sobre cómo está conformado su árbol de la vida, éste está lleno de simbolismos.
Empecemos con la música, el sonido de la lluvia es uno de mis favoritos desde niño, por eso es que se escucha al principio y al final de mi árbol, después está la influencia de mi abuelo materno que por su gusto y pasar tiempo en el tango influenció un poco en mi infancia, al igual que la cumbia por parte de mi abuelo paterno.
Desde pequeño he estado rodeado por ritmos güapachosos que te invitaban a bailar y por último el folklor mexicano, arraigado desde niño gracias a mis padres, ya que ellos bailaban y lograron que me sintiera identificado con esta música al grado de comenzar a practicar la danza y tomar la decisión de ser bailarín de folklor y ahora profesor.
Otro de los elementos que utilicé y que es parte de los simbolismos de mi árbol fue el rebozo, que significa la protección y el apapacho de mi familia, los zapatos que significan mis raíces, mi sentido de pertenencia a mi país y la humildad que un bailarín debe de tener arriba y abajo del escenario, el moño que representa la elegancia y presencia al bailar y, por último, el sombrero que como se pudieron dar cuenta es la copa del árbol y simboliza la mezcla de todos estos elementos para poder transmitirlos a mis alumnas y alumnos.
Realmente hermosa su representación a partir del movimiento.
El Reto de Hoy:
Termina tu árbol de la vida y compártelo con tus familiares, esto podría promover tu profundización o, incluso, el rescate de tu origen e historia familiar.
Jóvenes: raíces bien plantadas en la tierra y las ramas hacia las estrellas.
Descarga tu clase dando clic aquí
¡Buen trabajo!
Gracias por tu esfuerzo.

Compra en Amazon
Conspiraciones e insurrección de 1810
Aprendizaje esperado: Reconoce la multicausalidad de la crisis política en la Nueva España y el inicio de la guerra de Independencia.
Énfasis: Reconocer el golpe de Estado, las conspiraciones y la insurrección de 1810 como causas del inicio del movimiento de Independencia.
¿Qué vamos aprender?
Para realizar anotaciones, sólo necesitas lápiz o bolígrafo, cuaderno, y tu libro de texto, por si deseas profundizar y ampliar tus conocimientos acerca del tema.
En el ayuntamiento de la Ciudad de México, al propagarse la noticia de la imposición de José Bonaparte en el trono español, dos criollos destacaron como voceros del autonomismo: Juan Francisco Azcárate y Lezama y Francisco Primo de Verdad y Ramos. Ambos proponían que las instituciones de la Nueva España debían asumir la soberanía de la nación y el ejercicio de gobierno, para conservarlos en ausencia del monarca hasta su liberación y restitución en el trono.
¿Qué hacemos?
Lee los siguientes fragmentos de sus argumentos. El primero es de Francisco Azcárate, pronunciado el 19 de julio de 1808:
Por ausencia [del rey] e impedimento reside la soberanía representada en todo el reino, y las clases que lo forman, y con más particularidad en los tribunales superiores que lo gobiernan, administran justicia, y en los cuerpos que llevan la voz pública, que la conservarán intacta, la defenderán y sostendrán con energía como un depósito sagrado, para devolverla, o al mismo señor Carlos IV, o a su hijo el señor príncipe de Asturias, o a los señores infantes cada uno en su caso y vez quedando libres de la actual opresión a que se miran reducidos […].
El siguiente es de Francisco Primo de Verdad, emitido el 12 de septiembre de 1808:
Dos son las autoridades legítimas que reconocemos, la primera es la de nuestros Soberanos, y la segunda de los Ayuntamientos aprobada y confirmada por aquellos.
La primera puede faltar faltando los Reyes y de consiguiente falta en los que la han recibido como una fuente que mana por canales diversos; la segunda es indefectible, por ser inmortal el pueblo, y hallarse en libertad no habiendo reconocido otro soberano extranjero que le oprima con la fuerza, y a quien haya manifestado tácita o expresamente su voluntad y homenajes […] No se diga pues que por semejantes solicitudes el Ayuntamiento pretende erigirse en soberano y romper los vínculos con que hasta aquí ha estado ligado al trono de sus Reyes; diste de nosotros una impostura tan villana y falsa, coma indigna de la acendrada lealtad de la Nueva España; jamás por jamás ha dado este noble pueblo la menor queja a sus Reyes, ni desde la época de su conquista se presenta un motivo justo que lo obligue a dudar de su fidelidad.
A éstos se unió el fraile Melchor de Talamantes, quien publicó en Representación Nacional de las Colonias, lo siguiente:
Cuando los reinos se hallan tranquilos, las sociedades bien organizadas y las autoridades públicas en posesión legítima de todas sus facultades, a ningún individuo del Estado es permitido esparcir ideas nuevas que alteren la constitución establecida, trastornen el orden e inciten al pueblo a la insubordinación.
Mas hallándose todo un reino en la anarquía, incierto su destino, amenazado de graves males y privado de bienes que le son indispensables entonces es un deber esencialísimo de cada miembro de la sociedad levantar la voz con energía y resolución y comunicar a todos los habitantes las luces que puedan contribuir a su conservación y felicidad.
- ¿Qué conceptos similares identificaste en los tres pronunciamientos?
- ¿Cuál era su propuesta de gobierno ante la ausencia de los monarcas españoles?
- ¿Buscaban la independencia de España? ¿Por qué?
Antes de entrar en materia, realiza un breve repaso. Como recordarás, en la segunda mitad del siglo XVIII la población de la Nueva España empezó a resentir con mayor fuerza los efectos económicos de la guerra de los Siete Años, librada de 1756 a 1763, entre las potencias europeas Francia, Inglaterra y España, que buscaban ampliar sus dominios coloniales.
Esta guerra marcó el inicio de una serie de conflictos que extendieron el escenario de combate al continente americano.
Para financiar a sus ejércitos, la monarquía española implementó una serie de medidas administrativas, conocidas como Reformas Borbónicas, para aumentar la recaudación fiscal en sus dominios mediante nuevos impuestos, monopolios y préstamos obligatorios. Medidas similares de las otras monarquías europeas propiciaron la independencia de las Trece Colonias de Norteamérica (1776), la Revolución francesa (1789) y la independencia de Haití (1804).
Estos acontecimientos tuvieron una honda resonancia en las colonias iberoamericanas, pero sería 1808 un año determinante. Francia rompió su alianza con la monarquía española e invadió la península ibérica. El rey Carlos IV renunció a su corona y el heredero Fernando VII fue capturado por Napoleón, éste impuso en el trono español a su hermano José Bonaparte. El pueblo español se levantó en armas contra la invasión el 2 de mayo de 1808, inició la resistencia, asumió la soberanía y convocó a Cortes, la instancia que en circunstancias excepcionales reunía a los representantes del clero, la nobleza y el pueblo llano.
Dos meses y medio después de iniciados estos acontecimientos, llegaron las noticias a la Nueva España y se difundieron a través de la Gazeta de México, en ella se podía leer la declaración de Carlos IV en Bayona del 8 de mayo:
[…] por un tratado firmado y ratificado, he cedido a mi aliado y caro amigo el Emperador de los franceses [Napoleón Bonaparte] todos mis derechos sobre España e Indias […] Tendréis entendido, y así lo comunicaréis a los demás consejos, a los tribunales del reino, jefes de las provincias tanto militares como civiles y eclesiásticos, a fin de que este último acto de mi soberanía sea notorio a todos en mis dominios de España e Indias.
En la Nueva España la noticia causó inquietud en torno a la continuidad del gobierno colonial. En la ciudad de México, el sector criollo propuso, a través del ayuntamiento, que ante la falta de una autoridad estable en España se erigiera una Junta soberana con miembros de las élites para representar las ciudades, corporaciones y autoridades tradicionales.
El 19 de julio de 1808, el ayuntamiento la Ciudad de México, en su carácter de “cabeza del reino”, se reunió y aprobó un acta escrita por el regidor Juan Francisco Azcárate, quien la presentó ante el virrey José de Iturrigaray, en la que se declaraba la fidelidad al rey por parte de los súbditos americanos, se desconocían, por inválidas, las abdicaciones reales, así como la necesidad de clarificar el rumbo y el destino del virreinato en ausencia del soberano legítimo.
Una nueva representación por parte de Francisco Primo de Verdad vino a reforzar la postura fidelista y a la vez autonomista del cabildo capitalino. Si el rey se encontraba imposibilitado para gobernar, el pueblo asumiría la soberanía que le habría delegado.
En circunstancias extraordinarias, la autoridad no residía en el virrey ni en los demás funcionarios, sino a través de sus estamentos organizados y sus tribunales, como el ayuntamiento. Así pues, los ayuntamientos eran los organismos representativos.
Cuando el virrey José de Iturrigaray conoció la propuesta del ayuntamiento, convocó a una junta general el 9 de agosto, que él mismo presidió, en la cual se reunieron las autoridades superiores de la Nueva España, tanto civiles como eclesiásticas.
La Real Audiencia, que era el tribunal más alto de la Corona española, abogó por mantener el orden establecido, mientras el ayuntamiento enunció la facultad de asumir el control político virreinal hasta el restablecimiento del soberano en su trono. En reuniones subsecuentes se reafirmaron ambas posiciones.
Lo que siguió fue el inicio de un enfrentamiento entre peninsulares y criollos. Los primeros pretendían mantener el orden de las cosas como hasta ese momento se encontraban, y los segundos vieron la oportunidad de ganar autonomía.
Los criollos manifestaban que este gobierno autónomo evitaría cualquier conmoción social de descontento, y que sería provisional hasta que el rey Fernando VII regresara a España.
El sector peninsular temía que el proceso se radicalizara en un movimiento independentista y acabara con sus privilegios de clase dominante.
Cuando el virrey se inclinó por la postura autonomista, las grandes corporaciones políticas del virreinato vieron un cambio irreversible que afectaría sus intereses económicos.
Por ello, la noche del 15 de septiembre de 1808, un grupo de hombres armados, encabezados por el comerciante y hacendado Gabriel Yermo, comandaron un golpe de Estado, es decir, la destitución de la máxima autoridad. Alrededor de 300 hombres del comercio, que asumieron la representación del pueblo, asaltaron el palacio virreinal, tomando preso al virrey y a su familia.
Con la aprobación de los españoles de la Real Audiencia, se optó por el uso de la fuerza para aprehender a los principales promotores del proyecto autonomista y sustituir al virrey. La Real Audiencia asumió el poder y nombró al mariscal Pedro Garibay como virrey de la Nueva España.
El 16 de septiembre de 1808, un día después del golpe de Estado, para justificar el apresamiento y destitución del virrey Iturrigaray, la Real Audiencia, a nombre del pueblo, circuló una proclama:
Habitantes de México de todas clases y condiciones: […] El pueblo se ha apoderado de la persona del excelentísimo virrey, ha pedido imperiosamente su separación por razones de utilidad y conveniencia general.
Las nuevas autoridades también aprehendieron a Francisco Primo de Verdad y Juan Francisco de Azcárate, el abad de la villa de Guadalupe José Beye Cisneros, el canónigo José Mariano Beristáin, el licenciado José Antonio del Cristo y el mercedario Melchor de Talamantes.
Primo de Verdad fue asesinado días después en la cárcel del arzobispado. Melchor de Talamantes fue arrestado y se le formó causa de Estado. Su biblioteca fue registrada y se le incautaron todos sus manuscritos, entre ellos: “Apuntes para Plan de Independencia”, y “Congreso Nacional del Reino de Nueva España”; por su radicalismo fue reprimido por las autoridades eclesiásticas y la Real Audiencia.
En marzo de 1809 se decidió enviarlo a España para la continuación de su proceso. Recluido en el Fuerte de San Juan de Ulúa, en espera de ser embarcado, enfermó de fiebre amarilla y murió.
Por su parte, Iturrigaray fue enviado prisionero a España para su continuar su proceso por infidencia. Estuvo preso en el castillo de Santa Cecilia en Cádiz, y por intercesión de influencias, en 1810, pudo acogerse a la amnistía general promulgada por las Cortes. Falleció en Madrid en 1815.
La Junta de Seguridad y Buen Orden absolvió a Juan Francisco Azcárate de los cargos de infidencia y se le permitió la continuación de su desempeño en el ayuntamiento. En septiembre de 1821 fue uno de los firmantes del Acta de Independencia del Imperio Mexicano.
Este golpe de Estado, apoyado por el clero, los altos mandos del ejército y las élites españolas, así como la aprehensión y muerte de principales promotores, acabó con el primer intento de asumir la soberanía en la Nueva España. Observa un breve recuento a través del siguiente video del minuto 16:07 al 18:20.
- Camino a la Independencia
https://www.youtube.com/watch?v=oMUNE4Vb6-Q&t=1284s
Cuando fue desmantelada la iniciativa autonomista impulsada por Primo de Verdad y Francisco Azcárate, surgieron varios grupos de criollos inconformes con la situación de exclusión en la que vivían en la sociedad novohispana en relación con los peninsulares y comenzaron a reunirse clandestinamente.
Esos grupos de conspiradores, compuestos por mujeres y hombres, mayormente criollos pertenecientes al sector medio del clero, de la milicia y algunos comerciantes, se reunían con el pretexto de tertulias literarias.
Estas reuniones buscaban revertir la situación y trazar el camino hacia la autonomía que en 1810 transmutó lentamente hacia una revolución de independencia.
En 1809, en la ciudad de Valladolid, hoy Morelia, se reunía un grupo de conspiradores en la casa de José García Obeso, la lideraban los hermanos Mariano y Nicolás Michelena, María del Carmen Fernández Barrera Amat y María Josefa de la Riva. Su intención era apresar a las autoridades y formar la anhelada junta de gobierno de la Nueva España. En diciembre de ese año fueron delatados; los líderes, encarcelados, enjuiciados y liberados tiempo después.
El proyecto de los conspiradores continuó en Querétaro, con el párroco Miguel Hidalgo, el militar Ignacio Allende, los corregidores Miguel Domínguez y Josefa Ortiz, los hermanos Epigmenio y Emeterio González, tenderos del pueblo, entre otros.
Observa el siguiente sobre la conspiración de Valladolid de 1809 y su influencia.
- La conspiración de Valladolid
https://www.youtube.com/watch?v=WRpK2Z83j3c
Antes de concluir realiza una breve recapitulación.
Ante las noticias de la invasión napoleónica y la ausencia de rey español, en 1808 el regidor Francisco Azcárate envió al virrey Iturrigaray una representación donde se refrendaba la fidelidad al rey por parte de los súbditos americanos y se desconocían las abdicaciones reales.
Secundado por otros criollos como Primo de Verdad, se afirmaba que, al ayuntamiento, en concertación con las demás corporaciones del reino, le competía asumir la soberanía de la nación y el ejercicio de gobierno para conservarlos en ausencia del monarca hasta su restitución en el trono.
Lo que siguió fue el inicio de un enfrentamiento entre quienes pretendieron mantener el orden de las cosas como hasta ese momento se encontraban y quienes vieron la oportunidad de ganar autonomía, llenando el vacío de poder que dejaron las abdicaciones con la organización de una representación americana gobernante.
Con un golpe de Estado contra el virrey Iturrigaray y la aprehensión de los promotores de autonomismo, fue erradicada la primera opción de autogobierno, pero, ante esta situación, los criollos comenzaron a organizarse clandestinamente.
Después de ser descubiertas por las autoridades realistas las conspiraciones de Valladolid en 1809, y la de Querétaro en 1810, el 16 de septiembre Miguel Hidalgo salió de Dolores con apenas 600 seguidores.
En los siguientes meses se sumaron a la causa miles de mujeres y hombres criollos, indígenas y castas, y conforme la movilización armada se propagaba geográficamente, la insurrección se convirtió en una guerra que se prolongó poco más de una década, como estudiarás más adelante.
El Reto de Hoy:
El movimiento independentista iniciado en 1810 fue multicausal, es decir que confluyeron diversas causas tanto internas como externas. En tu cuaderno u hojas enlista cuáles fueron los procesos históricos que influyeron en la Nueva España y el inicio de su independencia; deberás, en cada uno, redactar un argumento que responda: ¿por qué fue un factor que propició el movimiento de Independencia?
Para resolver el reto, puedes apoyarte en tu libro de texto de Historia de México de tercer grado.
Descarga tu clase dando clic aquí
¡Buen trabajo!
Gracias por tu esfuerzo.
Compra en Amazon











Publicar un Comentario